 |
| Gases nobles |
Y, ¿qué es un enlace químico?: un enlace químico es un conjunto de fuerzas que mantiene unidos a los átomos de distintos o de un mismo elemento.
-Regla del octeto
Y te preguntaras, ¿cómo se consigue ese estado de máxima estabilidad y mínima energía?
Pues la regla del octeto defiende que todos los átomos tienen en su primera corteza de electrones, dos electrones, y a partir de la segunda corteza, ocho. Este estado de máxima estabilidad y mínima energía se consigue cuando la última capa de un átomo está completa.
Por eso, los gases nobles son los único átomos que se encuentran aislados en la naturaleza, porque no necesitan enlazarse con nadie.
Por ejemplo, si vamos a la tabla periódica y nos fijamos en el número atómico del cloro y del sodio, veremos que el cloro tiene 17 protones y el sodio 11 (por lo tanto 17 y 11 electrones respectivamente).
Agrupando a los electrones en cortezas, el sodio tiene 2 electrones en la primera, 8 en la segunda, y 1 en la tercera (porque no le quedan más); el cloro tiene 2 en la primera, 8 en la segunda, y 7 en la tercera. Observamos que el sodio para tener completa su última capa le convendría perder el electrón de la tercera capa, y al cloro ganar un electrón para completar su última capa. Por ello el sodio le da el electrón que le sobra al cloro, teniendo el cloro y el sodio finalmente 8 electrones en su última capa. Así es como se forma el enlace clorura de sodio (NaCl), que no es más que sal común.
| Enlace del sodio (Na) y el cloro (Cl): (NaCl) |
-Electrones de valencia
 La reactividad química de un elemento viene determinada principalmente por los electrones con más energía. Estos son siempre los electrones que ocupan la última capa, y se llaman electrones de valencia. Por ejemplo, el potasio tiene 1 electrón de valencia; el flúor, 7, y el oxígeno, 6.
La reactividad química de un elemento viene determinada principalmente por los electrones con más energía. Estos son siempre los electrones que ocupan la última capa, y se llaman electrones de valencia. Por ejemplo, el potasio tiene 1 electrón de valencia; el flúor, 7, y el oxígeno, 6.A la hora de representar la configuración electrónica de un elemento, se puede simplificar indicando solo los electrones de valencia. Para ello se utilizan los símbolos de Lewis. En esta notación, un punto significa un electrón, y un guión, dos (aunque se pueden utilizar solo puntos en vez de guiones.
-Moléculas y redes cristalinas
Los enlaces químicos pueden ser de dos tipos:
- Molécula: cuando se trata de una agrupación concreta de átomos.
Por ejemplo, el H2O, que es una molécula, nos indica que en una molécula hay 2 átomos de hidrógeno y uno de oxígeno.
- Cristales: cuando se trata de una estructura de millones y millones de átomos ordenados regularmente en el espacio.
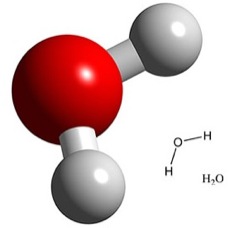 |
| Molécula del agua (H20) |
Por ejemplo, el NaCl que es un cristal, su formula no indica que en un átomo haya un átomo de sodio y otro de cloro, sino que hay millones.
 |
| Cristal del cloruro de sodio (NaCl) |
-Fórmulas químicas
Una fórmula química es la representación de una sustancia química, que informa de las clases de elementos que componen la sustancia y, mediante subíndices numéricos, de la proporción en la que se encuentra dicha sustancia.
Fórmula de una molécula
 |
| El azufre se presenta en la naturaleza en forma moléculas de 8 átomos (S8) |
Una fórmula molecular indica el número exacto de átomos de cada elemento que hay en la molécula. Así, por ejemplo, el S8 (azufre) indica que cada molécula de azufre (en roca) tiene ocho átomos de azufre,o el CH4 (metano), que indica que cada molécula de metano contiene un átomo de carbono y 4 de hidrógeno.
Fórmula de una red cristalina
La fórmula química que representa una sustancia formada por una red cristalina recibe el nombre de fórmula molecular.
Una fórmula empírica indica sólo la proporción relativa entre los átomos de cada elemento que hay en la red cristalina. Así, por ejemplo, el dióxido de silicio se representa por la fórmula (SiO2), lo que indica que la proporción en la red cristalina es de un átomo de silicio por cada dos átomos de oxígeno.
Si una red cristalina está formada por un solo tipo de átomos, su fórmula es el símbolo del elemento. Por ejemplo, la fórmula del hierro es simplemente Fe.

No hay comentarios:
Publicar un comentario